Abstracto: Los investigadores revelaron la estructura 3D del canal de proteína Flycatcher1 que permite que la trampa para moscas de Venus se cierre en respuesta a la presa. Los resultados arrojan luz sobre cómo funcionan otros canales iónicos mecanosensibles en plantas, otras bacterias y el cuerpo humano.
fuente: Instituto de Investigación Scripps
Los científicos de Scripps Research han revelado la estructura 3D de Flycatcher1, un canal de proteína acertadamente llamado que puede permitir que las plantas trampa para moscas de las flores se apaguen en respuesta a la presa.
La estructura Flycatcher1 se publicó el 14 de febrero en Comunicaciones de la naturalezaayuda a resaltar preguntas de larga data sobre la respuesta táctil notablemente sensible de las trampas para moscas de las flores.
La estructura también brinda a los investigadores una mejor comprensión de cómo funcionan proteínas similares en organismos, incluidas plantas y bacterias, así como proteínas en el cuerpo humano con funciones similares (llamados canales iónicos mecanosensibles).
«Aunque las trampas para moscas de las flores son diferentes de las de los humanos, estudiar la estructura y la función de estos canales mecánicamente sensibles nos brinda un marco más amplio para comprender las formas en que las células y los organismos responden al tacto y la presión», dice el coautor principal y profesor de investigación de Scripps, Andrew Ward. , Doctor.
El coautor principal Ardem Patapoutian, PhD, profesor de investigación Scripps ganador del Premio Nobel en Fisiología o Medicina, se suma a su investigación sobre los canales mecánicos sensibles que permiten que el cuerpo sienta el tacto y la temperatura.
Los canales iónicos mecanosensibles son como túneles que se extienden sobre las membranas celulares. Cuando están llenos de movimiento, los canales se abren, permitiendo que las partículas cargadas salgan. En respuesta, las células cambian su comportamiento: una neurona puede enviar una señal a su vecino, por ejemplo.
La capacidad de las células para sentir la presión y el movimiento es importante para el sentido del tacto y el oído de las personas, pero también para muchos procesos internos del cuerpo, desde la capacidad de la vejiga para sentirse llena hasta la capacidad de los pulmones para sentir cuánto aire se está respirando.
Previamente, los científicos se habían decidido por tres canales iónicos en las trampas para moscas de Venus que se cree que están relacionados con la capacidad de la planta carnívora para cerrar sus hojas cuando se tocan sus delicados pelos. Uno, Flycatcher1, llamó la atención de los investigadores porque su secuencia genética se parece a una familia de canales mecánicos sensibles, MscS, que se encuentran en las bacterias.
Dice el primer coautor Sebastian Jojo Cruz, estudiante de posgrado en Scripps Research.
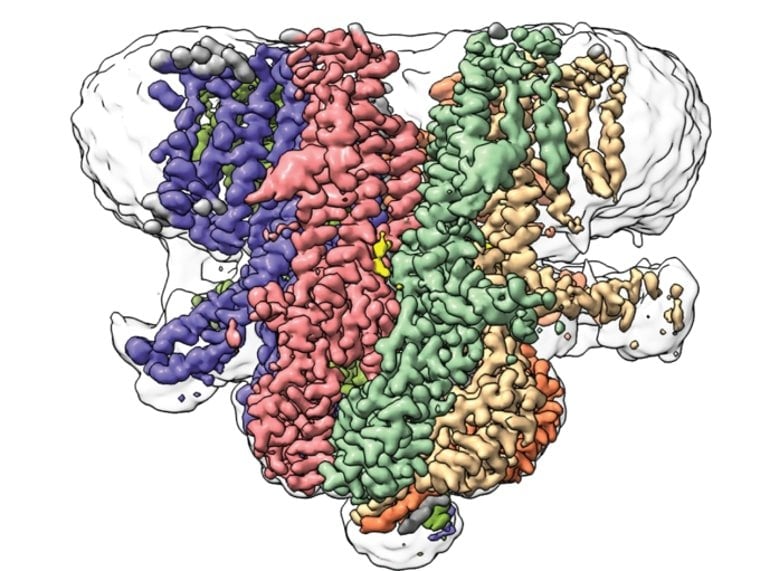
En el nuevo estudio, los investigadores utilizaron microscopía crioelectrónica, una tecnología de punta que detecta la ubicación de los átomos dentro de una muestra de proteína congelada, para analizar la disposición exacta de las moléculas que componen el canal de proteína Flycatcher1 en plantas trampa de flores. Descubrieron que Flycatcher1 es similar, en muchos aspectos, a las proteínas bacterianas MscS: siete grupos de hélices idénticas que flanquean un canal central.
Pero, a diferencia de otros canales MscS, Flycatcher1 tiene una región enlazadora inusual que se extiende hacia afuera desde cada conjunto de hélices. Como un interruptor, cada enlace se puede voltear hacia arriba o hacia abajo. Cuando el equipo determinó la estructura de Flycatcher1, encontraron seis eslabones en la posición inferior y solo uno volteó hacia arriba.
dice Kei Saotome, PhD, ex investigador postdoctoral en Scripps Research y coautor del nuevo artículo de investigación.
Para ayudar a explicar la función de estos interruptores, los investigadores cambiaron el enlazador para desactivar la posición superior. Descubrieron que el papamoscas 1 ya no funcionaba como de costumbre en respuesta a la presión; El canal permaneció abierto más tiempo cuando normalmente estaría cerrado cuando se elimina la presión.
«El profundo efecto de esta mutación nos dice que hacer coincidir estos siete enlaces probablemente sea relevante para el funcionamiento del canal», dice la coautora principal Suetha Murthy, Ph. Associate en Scripps Research.
Ahora que han resuelto la estructura molecular, el equipo de investigación está planeando futuros estudios sobre la función de Flycatcher1 para comprender cómo las diferentes conformaciones afectan su función. También se necesita más trabajo para determinar si Flycatcher1 es el único responsable del cierre abrupto de las hojas de las trampas para moscas de las flores, o si otros canales sospechosos juegan papeles complementarios.
Además de Jojoa-Cruz, Saotome, Murthy, Patapoutian y Ward, los autores del estudio, «Structural Insights into the Sensitive Flycatcher Ion Channel 1», son Che Chun Alex Tsui y Wen-Hsin Lee de Scripps Research, y Mark Sansom de Universidad de Oxford.
Financiación: Este trabajo y los coinvestigadores recibieron el apoyo financiero de los Institutos Nacionales de Salud (R01 HL143297, R01 HL143297), la subvención de la Fundación Ray Thomas Edwards, Wellcome Trust (subvención 208361/Z/17/Z), el Consejo de Investigación de Biotecnología y Ciencias Biológicas ( beca BB/N000145)./1 y BB/R00126X/1), Consejo de Investigación de Ingeniería y Ciencias Físicas (beca EP/R004722/1), Beca Postdoctoral de Jane Coffin Childs Memorial Fund for Medical Research, Skaggs-Oxford Scholarship, Crusher Foundation y el Instituto Médico Howard Hughes.
Sobre esta investigación en Neuroscience News
autor: oficina de prensa
fuente: Instituto de Investigación Scripps
Llamar: Oficina de Prensa – Instituto de Investigación Scripps
imagen: Imagen acreditada al Instituto de Investigación Scripps
búsqueda original: acceso abierto.
«Información estructural sobre el canal iónico mecánicamente sensible Flycatcher en Venus flytrap 1Escrito por Ardem Patapoutian et al. Comunicaciones de la naturaleza
Resumen
Información estructural sobre el canal iónico mecánicamente sensible Flycatcher en Venus flytrap 1
Flycatcher1 (FLYC1), un homólogo de MscS, ha sido identificado como un canal iónico candidato mecanosensible (MS) involucrado en el reconocimiento de presas de atrapamoscas de Venus. FLYC1 es una proteína más grande y su secuencia diverge de los homólogos de MscS estudiados previamente, lo que indica que tiene características estructurales únicas que contribuyen a su función.
Aquí, caracterizamos FLYC1 por microscopía electrónica, simulaciones de dinámica molecular y electrofisiología. Similar a MscS bacteriano y al cultivo de canales MSL1, encontramos que el centrosoma de FLYC1 incluye puertas laterales en la jaula citoplasmática que regulan la conducción y la preferencia de iones, mediante la identificación de residuos críticos que modulan la conducción del canal.
Las regiones flanqueantes citoplásmicas topológicamente únicas pueden adoptar una conformación ‘arriba’ o ‘abajo’, lo que hace que el canal sea asimétrico. La interrupción de una interacción específica de modulación provoca un retraso severo de 40 veces en la desactivación del canal debido a la estabilización del estado del canal abierto.
Nuestros resultados demuestran nuevas características estructurales y posibles transiciones conformacionales que regulan la activación mecánica de FLYC1.

«Propenso a ataques de apatía. Explorador de aspirantes. Analista ávido. Fanático de Internet. Comunicador»






More Stories
Probando nueva tecnología de mapeo 3D para transformar la exploración espacial y beneficiar a las industrias de la Tierra
¿Júpiter tiene anillos? Sí, lo es
El efecto de la dieta sobre las bacterias intestinales proporciona nuevas pistas en el tratamiento de la enfermedad de Parkinson