Tipos de células y su porcentaje en el SN de pacientes con EP
Según los resultados de la anotación celular en el portal unicelular subido por el grupo del profesor Macosko, las células se extrajeron y clasificaron en diferentes tipos de muestras SN humanas (Figura 1A). Después se extrajeron 135.344 células de 34 muestras de PD y 184.673 células de 45 muestras de control. Obtuvimos un total de siete poblaciones celulares principales, que eran neuronas dopaminérgicas, neuronas no dopaminérgicas, astrocitos, oligodendrocitos, OPC, células endoteliales/pericitos y microglía/macrófagos. Mediante el análisis estadístico de la proporción de células en cada muestra, encontramos que solo las neuronas dopaminérgicas disminuyeron significativamente en la pars compacta SN de los pacientes con EP, y que otros seis grupos de células no cambiaron obviamente (Figura 1B).
Tipos de células y sus proporciones en el SN de pacientes con EP y el grupo control (CN). A muestra varias muestras fusionadas para análisis estadístico. Se examinaron un total de 184.673 células de 45 sujetos con NC en el grupo de control, y el número total de todos los tipos de células se contó hasta el número total de células (184.673 células). Mientras se examinaron 135.344 células de 34 pacientes con enfermedad de Parkinson en el grupo de EP, se calculó la proporción de cada tipo de célula con respecto a la población total (135.344 células). B es el análisis estadístico del porcentaje de células en cada muestra individual utilizando T-TEST. Se utilizaron 45 muestras de CN y 34 pacientes con EP para el análisis estadístico, pero se excluyeron las muestras con 0% de datos en los gráficos. **s<0,01.
Identificación de DEG entre PD y grupos de control.
Los resultados del análisis genético diferencial para cada tipo de célula en el SN de pacientes con EP y controles se muestran en la Figura 2. Se marcan los cinco DEG con los mayores cambios de regulación hacia arriba y hacia abajo en cada tipo de célula. Los cinco genes más regulados positivamente en las neuronas dopaminérgicas fueron TRPM3, TTTY14, FLRT2, FOXP2 y SEZ6L, mientras que los cinco genes más regulados negativamente fueron GAPDH, EYA4, SEMA5A, TIAM2 y ALDH1A1 (Figura 2A). Los cinco genes con mayor regulación positiva en las neuronas no dopaminérgicas fueron TTTY14, MAP1A, NEFH, MT-ND4 y MT-ND3, mientras que los cinco genes con mayor regulación negativa fueron TSHZ2, GANLTL6, ASIC2, PMCH y HDC (Figura 2). B). . Los cinco genes más regulados hacia arriba en los astrocitos fueron HMGB1, HSPH1, PTGES3, SLC7A11 y HSPA4L, mientras que los cinco genes más regulados hacia abajo fueron ANGPTL4, ETNPPL, SLC4A4, SLC6A11 y LINC00499 (Figura 2C). Los cinco genes con mayor regulación positiva en los oligodendrocitos fueron HSPH1, HSPA1A, HSPB1, PTGES3 y HSP90AA1, mientras que los cinco genes con mayor regulación negativa fueron NAALADL2, MIR219-2, PPP2R2B, PDE1A y POLR2F (Figura 2D). Los cinco genes más regulados hacia arriba en OPC fueron HSPH1, CHORDC1, HSPA4L, PTGES3 y HSPA1A, mientras que los cinco genes más regulados hacia abajo fueron ROBO2, RYR2, TENM2, SYT1 y GANLTL6 (Figura 2E). Los cinco genes más regulados en células endoteliales/pericitos fueron HSPA1A, HSPB1, DNAJB1, HSPH1 y HSP90AA1, mientras que los cinco genes más regulados fueron ATP1A2, TXNIP, SLC6A1-AS1, TAGLN y HBB (Figura 2F). Los cinco genes más regulados hacia arriba en microglía/macrófagos fueron HSPH1, HSPB1, HSP90AA1, CHORDC1 y PTGES3, mientras que los cinco genes más regulados hacia abajo fueron CD14, SLC2A3, CCDC26, HAMP y TMEM163 (Figura 2G).
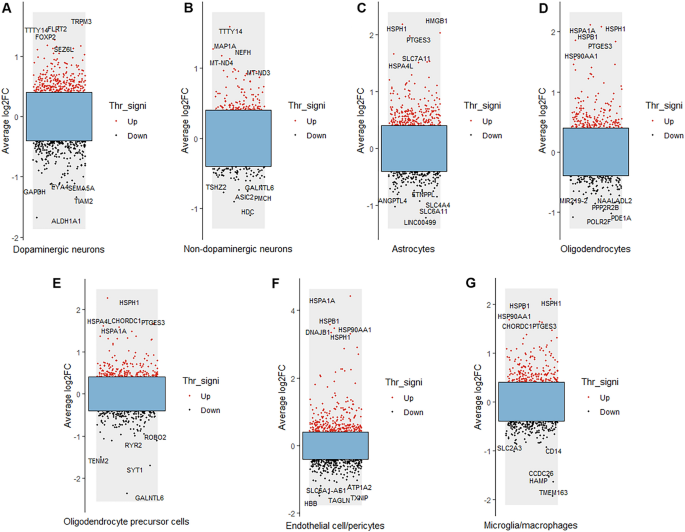
Resultados del análisis DEG para cada tipo de célula en la EP. Los puntos rojos representan genes regulados positivamente; Los puntos negros representan genes regulados negativamente. El log2FC promedio indica el cambio log2 promedio y Thr_signi representa el valor umbral y su importancia. Se proporcionan los cinco genes más regulados a la baja y los cinco genes más regulados a la baja en cada tipo de célula.
Examen de DEG relacionados con el hierro en siete tipos de células
Descargamos el gen asociado a ferroptosis de FerrDb v2. Entre los genes Fr, se seleccionaron genes verificados en humanos y se eliminaron los genes duplicados sobre la base del símbolo del gen. Entre estos genes, 5 genes (AQP3, AQP5, AQP8, DAZAP1, NT5DC2) no fueron anotados en los tejidos investigados, pero se confirmó que estaban asociados con la enfermedad del hierro en humanos consultando la literatura.19. Finalmente, mediante cribado se obtuvieron genes 401 Fr.
Los Fr-DEG para cada tipo de célula se identificaron mediante el método de cruce. Hubo 479 DEG en neuronas dopaminérgicas, con 11 Fr-DEG identificados (Figura 3A). Hubo 192 DEG en neuronas no dopaminérgicas, con 5 Fr-DEG identificados (Figura 3B). La diferencia en el número de DEG entre las neuronas dopaminérgicas y las no dopaminérgicas indica el daño específico a las neuronas dopaminérgicas en la EP. Los astrocitos mostraron 381°C, con una especificación de 22°F (Figura 3C). Había 301 DEG en los oligodendrocitos, con 15 Fr-DEG identificados (Figura 3d). Había 354 DEG en OPC, con 9 Fr-DEG identificados (Figura 3E). Hubo 516 DEG en células endoteliales/pericitos, con 25 Fr-DEG identificados (Figura 3F). Hubo 361 DEG en microglia/macrófagos, con 15 Fr-DEG identificados (Figura 3G). Todos los genes con expresión alterada se muestran en la Tabla 1. Aunque la expresión de FTH disminuyó en las neuronas dopaminérgicas, el cambio no se observó debido a p_val_adj > 0,05.
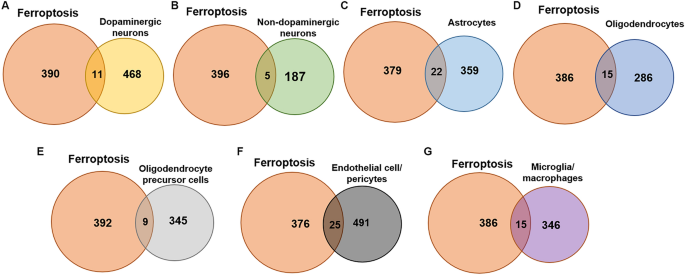
Fr-DEG en diferentes tipos de células.
Análisis de enriquecimiento de DEG en neuronas dopaminérgicas y construcción de redes PPI
La pérdida de neuronas dopaminérgicas en el SN es un sello distintivo de la fisiopatología de la EP. Por lo tanto, realizamos análisis de enriquecimiento y construcción de redes PPI de DEG a partir de neuronas de dopamina. El análisis de enriquecimiento de las neuronas dopaminérgicas DEG reveló principalmente cambios en el metabolismo del ATP, la respuesta celular al estrés, el comportamiento motor, las sinapsis dopaminérgicas, el ciclo de liberación de neurotransmisores de dopamina y la diferencia de potencial a largo plazo en las neuronas dopaminérgicas de pacientes con EP (Figura 4). El complemento clásico de Cytoscape MCODE (Detección de complejos moleculares) para Metascape se puede utilizar para detectar regiones de complejos moleculares estrechamente asociadas en una red PPI. Realizamos un análisis de enriquecimiento funcional en las subredes identificadas para dilucidar aún más el papel de estos complejos potenciales en la regulación de la vida. La red PPI muestra genes que tienen relaciones cooperativas con otros genes, en el contexto de los componentes MCODE (Figura 5). En general, los datos de MCODE no solo muestran relaciones diferenciales de expresión genética en la enfermedad de Parkinson y diversas enfermedades de Newcastle, sino que también muestran específicamente un enriquecimiento de la vía de fosforilación oxidativa.
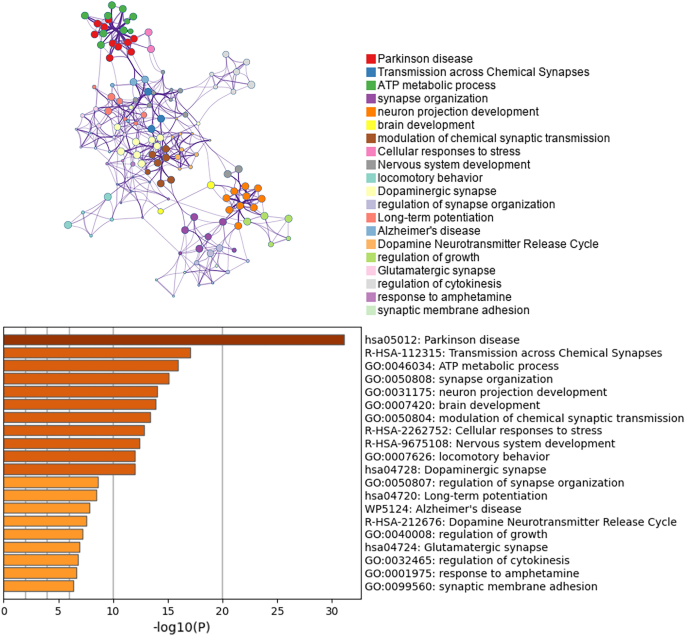
Resultados de agrupamiento jerárquico y árboles de agrupamiento para el enriquecimiento funcional de neuronas dopaminérgicas DEG. Justo sLa información del valor se muestra en un gráfico, que se puede comparar con un dendograma.
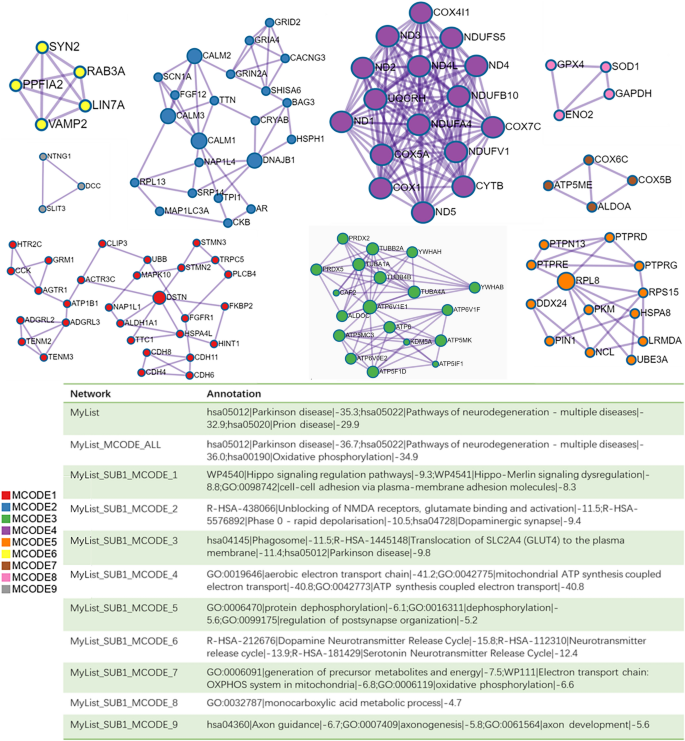
Resultados del análisis de componentes de red PPI y MCODE. Los genes que no interactúan con otros genes no se incluyen en la lista DEGS. La red PPI muestra genes que tienen relaciones cooperativas con otros genes y también tiene componentes MCODE. MCODE revela regiones complejas moleculares estrechamente vinculadas en la red PPI.
Identificación de proteínas secretadas de Fr-DEG en todas las células.
Las interacciones intercelulares son una característica esencial de las actividades celulares de la vida multicelular.20. Nuestra hipótesis es que la proteína secretada intracelular contribuye a la pérdida neuronal en la EP al afectar la sensibilidad de las neuronas dopaminérgicas a la ferroptosis. Para probar esto, anotamos las funciones genéticas de Fr-DEG en todos los tipos de células y luego examinamos los genes que codifican proteínas secretadas. Tres DEG codifican proteínas secretadas (HMGB1 [high-mobility group box 1 protein]CB [ceruloplasmin]T.F. [transferrin]) se han encontrado en pacientes con EP. Entre estos genes, la expresión de CP aumentó en los astrocitos, la expresión de HMGB1 aumentó en todos los tipos de células y la expresión de TF disminuyó en los oligodendrocitos (Tabla 2).
Detección de Fr-DEG que codifican proteínas secretadas en datos de microarrays
Utilizando los datos de RNA-seq recopilados en la base de datos GEO, investigamos la expresión alterada de los tres genes, HMGB1, CP y TF, en el SN de pacientes con EP. Los cambios genéticos a nivel del SN son consistentes con la hipótesis de que estas proteínas afectan a las neuronas dopaminérgicas. El aumento en la expresión de CP se verificó en los conjuntos de datos GSE49036 y GSE20164 (Tabla 3). Sin embargo, no se verificaron cambios significativos en HGB1 o TF, lo que puede deberse a diferencias técnicas entre los métodos de ensayo. Esto significa que los cambios a nivel de una sola célula no reflejan necesariamente cambios a nivel de tejido general.

«Propenso a ataques de apatía. Explorador de aspirantes. Analista ávido. Fanático de Internet. Comunicador»







More Stories
Se ha encontrado evidencia del Planeta 9 en cuerpos helados que pasan cerca de Neptuno
La investigación sobre hidruros supera los límites de la superconductividad práctica y accesible
Yokogawa está ayudando a revolucionar la ciencia de los lípidos unicelulares