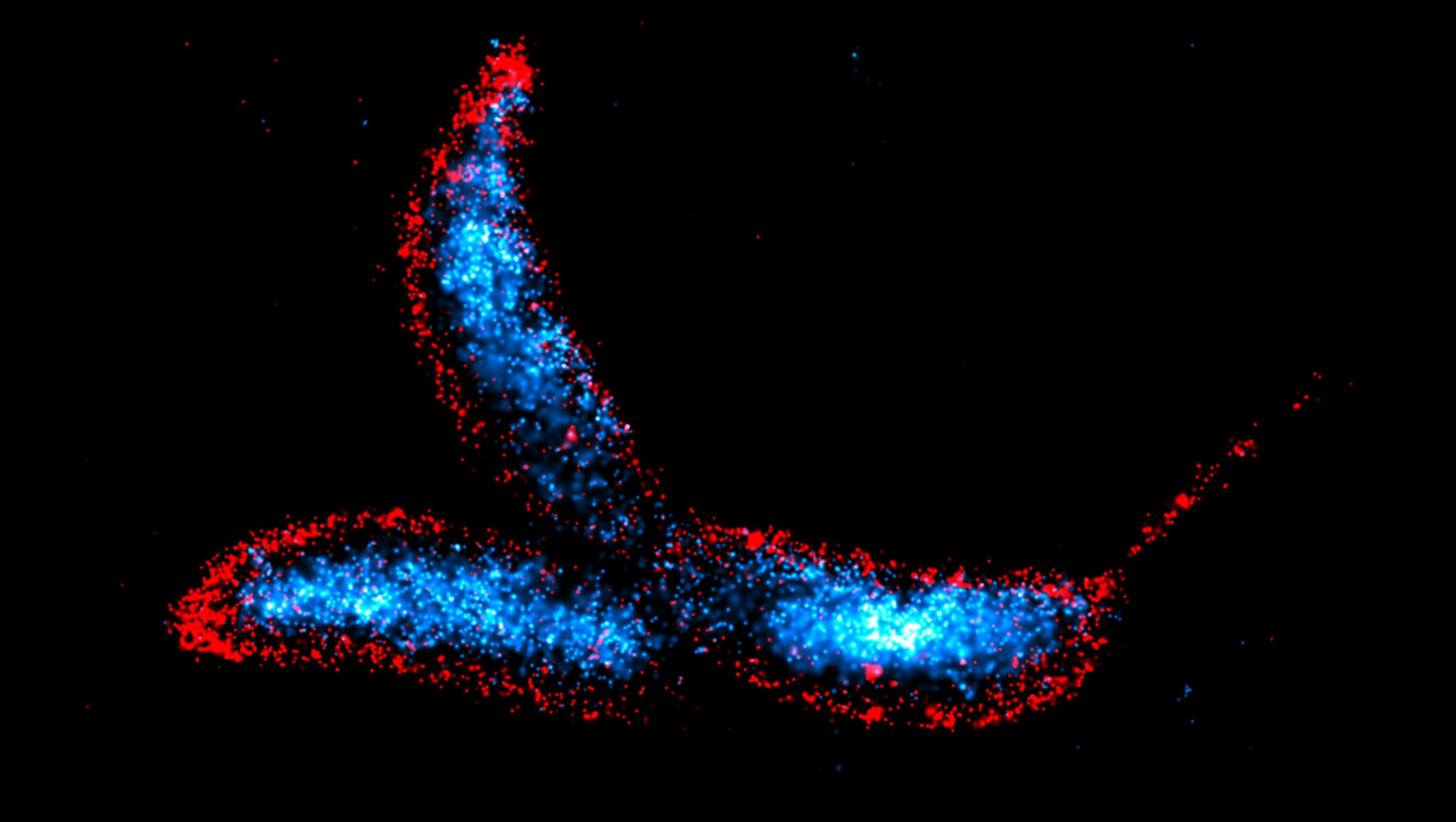
Media luna Caulobacter Es una bacteria dimórfica con forma de media luna que sirve como uno de los principales organismos modelo para el estudio de la regulación del ciclo celular bacteriano, la diferenciación celular y la morfogénesis. Las células se visualizaron utilizando la técnica DNA-PAINT, con el ADN cromosómico teñido de azul y las membranas celulares teñidas de rojo. Crédito: Instituto Max Planck de Microbiología Terrestre / Hernández Tamayo
Cómo una proteína reguladora actúa como una herramienta múltiple para la remodelación de la pared celular bacteriana.
Para que las células bacterianas crezcan y se dividan, sus paredes celulares deben remodelarse constantemente. Este proceso requiere un delicado equilibrio entre las enzimas líticas y la producción de peptidoglicanos. Un equipo de investigadores encabezado por Martin Thanbichler ha descubierto que un regulador central puede controlar clases completamente diferentes de autolisinas. Dado que muchos antibióticos atacan la pared celular bacteriana, este descubrimiento puede allanar el camino para nuevos métodos de tratamiento contra las infecciones bacterianas.
A lo largo de la evolución, las células han desarrollado una amplia variedad de estrategias para fortalecer su envoltura contra el estrés osmótico interno, lo que les permite prosperar en una variedad de entornos diferentes. La mayoría de las bacterias clasificar Forma una pared celular semirrígida que rodea la membrana citoplasmática, cuyo principal componente, el peptidoglicano, forma una densa red que envuelve a la célula.
Además de su papel protector, la pared celular también sirve como vehículo para generar formas celulares específicas, como esferas, bastones o espirales, que facilitan la motilidad, la colonización superficial y la patogenicidad.
La existencia de una pared celular presenta sus propios desafíos: las células deben remodelarse constantemente para crecer y dividirse. Para hacer esto, deben hacer laceraciones en la pared con mucho cuidado para permitir que se expanda y se desplace, mientras reparan rápidamente los huecos con material nuevo para evitar que se derrumbe. Este proceso de remodelación de la pared celular implica la escisión de ligandos por enzimas líticas, también conocidas como autolisinas, y la posterior inserción de nuevo material de pared celular por síntesis de peptidoglucano. Las actividades de estos dos grupos antagónicos de proteínas deben estar estrechamente coordinadas para prevenir puntos débiles en la capa de peptidoglicano que conducen a la lisis y muerte celular.
El equipo de investigación dirigido por Martin Thunbechler, becario Max Planck en el Instituto Max Planck de Microbiología Terrestre y profesor de Microbiología en la Universidad de Marburg, ha revelado la composición y función de la maquinaria de autolisis. Sus estudios se centran en bacterias en forma de media luna. Media luna Caulobacterque se encuentran en ambientes de agua dulce y se utilizan ampliamente como organismo modelo para estudiar procesos celulares esenciales en bacterias.
Según Thanbichler, estudiar la función de las autolisinas ha sido una tarea desafiante. «Si bien sabemos mucho sobre maquinaria sintética, las autolisinas han demostrado ser difíciles de descifrar». Maria Bellini, investigadora postdoctoral en el equipo de Thanbechler, agrega: «Las bacterias suelen contener muchos tipos de autolisinas de diferentes familias de enzimas con diferentes objetivos. Esto significa que estas proteínas son muy redundantes y la eliminación de genes de autolisina individuales a menudo tiene poco efecto». morfología y crecimiento”.
Organizador versátil
El análisis de los posibles reguladores de la autolisina mediante un ensayo de co-inmunoprecipitación y ensayos de interacción proteína-proteína in vitro reveló que un agente llamado DipM desempeña un papel fundamental en la remodelación de la pared celular bacteriana. Este regulador maestro, una proteína periférica soluble, interactúa sorprendentemente con varias clases de autolisinas además del factor de división celular, mostrando una promiscuidad previamente desconocida para este tipo de regulador.
DipM fue capaz de catalizar la actividad de dos enzimas de escisión de peptidoglicano con actividades de plegamiento y plegamiento completamente diferentes, lo que lo convierte en el primer regulador identificado que puede controlar dos clases de autolisinas. En particular, los resultados también indican que DipM utiliza una sola interfaz para interactuar con sus diversos objetivos.
«La inactivación de DipM conduce a una regulación a la baja en varios puntos del proceso de remodelación de la pared celular y mitosis y, en última instancia, mata a la célula», dice el estudiante de doctorado Adrián Izquierdo Martínez, primer autor del estudio. Su función adecuada como coordinador de la actividad de la autolisina es fundamental para el mantenimiento de la forma celular adecuada y la división celular. C. media luna. «
La caracterización exhaustiva de DipM ha revelado una red de interacción novedosa, que incluye un bucle de autorrefuerzo que une las transglucosilasas líticas y posiblemente otras autolisinas con el núcleo del aparato de división celular en C. media lunay posiblemente otras bacterias también. Por lo tanto, DipM orquesta una red compleja de autolisinas cuya topología difiere significativamente de la de los sistemas de autolisinas estudiados anteriormente. Martin Thunbechler señala: «Estudiar estos reguladores multienzimáticos, cuyo mal funcionamiento afecta a varios procesos relacionados con la pared celular al mismo tiempo, no solo nos ayuda a comprender cómo responde la pared celular a los cambios en la célula o el medio ambiente. También puede contribuir a el desarrollo de nuevas estrategias terapéuticas». Las bacterias contraatacan desactivando simultáneamente varias vías de autodegradación».
Referencia: “DipM controla varias autolisinas y media un ciclo de retroalimentación reguladora que promueve la contractilidad celular en Caulobacter crescentus” por Adrian Izquierdo-Martinez, Maria Bellini, Vega Miguel-Ruano, Rogelio Hernández-Tamayo, Pia Richter, Jacob Biboy, María T. Batuecas , Timo Glatter, Waldemar Vollmer, Peter L. Grauman, Joanne A. Hermoso y Martin Thunbechler 11 de julio de 2023 Disponible aquí. Comunicaciones de la naturaleza.
DOI: 10.1038/s41467-023-39783-w

«Propenso a ataques de apatía. Explorador de aspirantes. Analista ávido. Fanático de Internet. Comunicador»






More Stories
SpaceX ha lanzado 23 satélites Starlink desde Florida
Restaurar la testosterona después de dejar el TDA: ¿quién corre el riesgo de no recuperarse a largo plazo?
Los científicos finalmente han descubierto signos de vida en un planeta dos veces más grande que la Tierra.