Investigadores en los Estados Unidos han demostrado que la proteína de pico viral que el coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2) usa para infectar las células huésped adopta una conformación abierta que revela nuevos epítopos que podrían servir como objetivos para estrategias terapéuticas para protegerse contra coronavirus. Enfermedad 2019 (COVID-19).
Las vacunas COVID-19 aprobadas actualmente y muchas tecnologías de diagnóstico clínico se basan en el dominio de ectodominio agudo del SARS-CoV-2 que estabiliza la proteína en la formación generativa.
Ahora, un equipo de la Universidad de California en Berkeley, la Universidad de Texas en Austin y el BioHub Chan Zuckerberg en San Francisco ha identificado una nueva forma que muestra la interfaz de una herramienta de corte conservada que ha sido enterrada en un estado de arranque.
A continuación, esto revela epítopos potenciales para el reconocimiento global de anticuerpos y ligandos del coronavirus, dicen Susan Marcuse y sus colegas.
«El conocimiento de la estructura y los grupos de esta morfología ayudará a mejorar los diagnósticos, tratamientos y vacunas existentes», escribieron.
Una copia impresa del trabajo de investigación está disponible en bioRxiv* Servidor, mientras que el artículo está sujeto a revisión por pares.
Más acerca de Spike Viral Protein
El pico de SARS-CoV-2 es una proteína triplete grande que media en la etapa inicial del proceso de infección cuando el dominio de unión al receptor (RBD) se une al receptor 2 de la enzima convertidora de angiotensina (ACE2) de la célula huésped.
Poco después del lanzamiento de la secuencia del genoma del SARS-CoV-2 en enero de 2020, se desarrolló un transcriptoma del dominio de ectodominio de espiga, S-2P, que estabiliza la formación de constituyentes.
Este dominio externo S-2P se ha utilizado ampliamente para el desarrollo de vacunas y en varios estudios sobre la estructura y función del dominio externo espinoso. Más de 250 estructuras de dominios externos elevados de SARS-CoV2 están ahora disponibles en el Protein Data Bank.
«Estos estudios estructurales, junto con otros estudios funcionales, como todas las proteínas de fusión viral de clase 1, muestran que la proteína de pico es dinámica, muestreando varias estructuras diferentes durante su ciclo de vida funcional», dicen Marcusi y sus colegas.
Tres RBD individuales adoptan una conformación ‘hacia arriba’ y ‘hacia abajo’, con la conformación superior exhibiendo el motivo de unión de ACE2 requerido para la infección.
Después de la unión del receptor y la escisión entre las subunidades S1 y S2, el pico experimenta un evento de replegamiento para permitir la fusión, antes de adoptar posteriormente una similitud estable después de la fusión.
Sin embargo, Marcuse y sus colegas dicen que hay muy pocos estudios experimentales que brinden información sobre la dinámica del estado obstétrico.
«Experimentalmente, el panorama conformacional del pico no ha sido bien interrogado, y se desconocen los efectos de las perturbaciones, como la unión del ligando (tanto del receptor como del anticuerpo) o las sustituciones de aminoácidos presentes en las variantes emergentes de interés», escribió el equipo.
¿Qué hicieron los investigadores?
Los investigadores utilizaron el intercambio de hidrógeno deuterio monitoreado por espectrometría de masas (HDX-MS) para investigar los paisajes de banda hacia afuera de la altitud previa y el efecto de la unión y la variación de secuencia.
«HDX-MS proporciona un complemento ideal para el número cada vez mayor de estudios estructurales sobre la proteína SARS-CoV-2, proporcionando información sobre su ensamblaje conformacional y dinámica», dice el equipo.
Los resultados indicaron que la proteína de pico llena dos conformaciones dentro del estado generativo: la estructura del núcleo generativo (caso A) y otra conformación inesperada con una interfaz de recorte abierta más expuesta (caso B).
Cuando los investigadores usaron la temperatura para alterar la estructura, se encontró que los dos confórmeros se desplazaban inversamente, con el estado B a 4 ° C y el estado A a 37 ° C preferido.
La nueva forma es una recortadora abierta
El caso B revela una interfaz de trímero S2 conservada que, por lo demás, está enterrada en la preforma, lo que proporciona nuevos epítopos potenciales para el reconocimiento global de anticuerpos y ligandos de MERS.
Para probar si las mutaciones podrían afectar la interconversión de las conformaciones A y B, el equipo monitoreó la conversión de una variante de HexaPro que incluye cinco mutaciones presentes en S1 de la variante B.1.1.7 (alfa) que ha surgido en el Reino Unido. .
De hecho, el UK S1 HexaPro mostró diferencias tanto en la preferencia relativa por el estado B como en la cinética de interconversión.
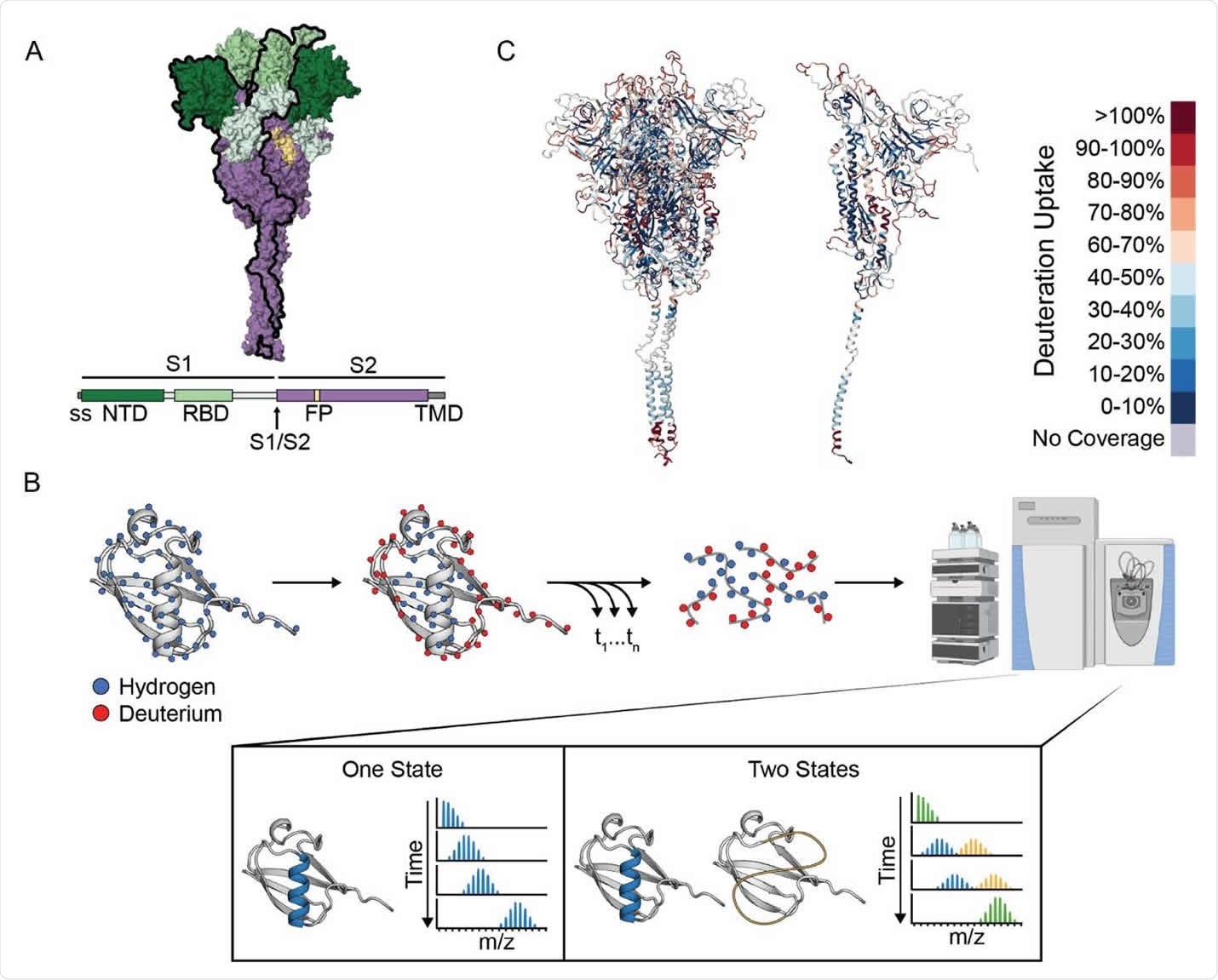
Intercambio de hidrógeno-deuterio monitoreado por espectrometría de masas (HDXMS) en el campo exterior del pico SARS-CoV-2. (a) Diagrama esquemático de una proteína SARS-CoV-2 previa a la fusión estable y un modelo para la formación previa de tripletes (24). (B) Esquema del experimento HDX-MS y las distribuciones de masa resultantes de un péptido presente en uno (izquierda) o dos (derecha) separables. Para que las dos conformaciones den como resultado una distribución de masa bimodal, no deben cambiar durante la escala de tiempo del experimento HDX (horas). La interconversión rápida puede resultar en una única distribución de masa con un perfil de masa promedio del grupo. (C) Representación esquemática de la adsorción de deuterio a través de toda la proteína de pico que se muestra en todo el incisivo (izquierda) o en un solo protómero (derecha) después de 1 min de intercambio.
A 4 ° C, el UK S1 HexaPro se convirtió al estado B aproximadamente 20 veces más rápido que el HexaPro original.
«Por lo tanto, a pesar de su ubicación en la subunidad S1 en lugar de en la interfaz del recortador central, las mutaciones específicas de B.1.1.7 afectan la interconversión de estos dos estados», escribieron los investigadores.
Prueba de efectos de anticuerpos recientemente desarrollada
Un anticuerpo desarrollado recientemente llamado 3A3 que se une tanto al SARS-CoV-1 como al SARS-CoV-2 se dirige a un epítopo ubicado en la región del pico (alrededor de los residuos 980 a 1000) que Marcuse y sus colegas observaron previamente con un comportamiento bimodal.
Sin embargo, esta región se ha considerado inaccesible porque está enterrada en la estructura de arranque cuando todos los RBD están inactivos y también está cerrada cuando los RBD están arriba.
Curiosamente, los datos HDX indicaron la exposición de esta región después de la conversión al estado B.
Cuando el equipo repitió el experimento HDX en presencia de 3A3, se observó un aumento significativo en el nivel de protección en la región 978-1001 que se asoció directamente con la condición B.
¿Qué concluyeron los autores?
Los investigadores dicen que la comprensión adicional de esta condición B recientemente identificada ayudará a mejorar el desarrollo de diagnósticos, tratamientos y vacunas.
«En conjunto, los datos sugieren que el caso B revela epítopos ampliamente sensibles a la neutralización que pueden ser de interés para futuras terapias y vacunas», dicen Marcuse y sus colegas.
Además, estos epítopos se encuentran en la parte más conservada del pico, la interfaz del trímero S2, y por lo tanto representan un objetivo ideal para las vacunas que proporcionarían protección a través de diferentes coronavirus.
*Nota IMPORTANTE
bioRxiv Publica informes científicos preliminares que no han sido revisados por pares y, por lo tanto, no deben considerarse concluyentes, guiar la práctica clínica / comportamiento relacionado con la salud o tratarse como información establecida.

«Propenso a ataques de apatía. Explorador de aspirantes. Analista ávido. Fanático de Internet. Comunicador»






More Stories
Las barras estelares muestran que las primeras galaxias del universo evolucionaron mucho más rápido de lo que se pensaba
Las explosiones de la galaxia NGC 4383 liberan varios elementos al espacio interestelar
Las vacas proporcionan pistas para tratar la infertilidad en humanos