A medida que la Enfermedad del Coronavirus 2019 (COVID-19), causada por el síndrome respiratorio agudo severo, Coronavirus 2 (SARS-CoV-2), continúa causando estragos a nivel mundial, la fuente exacta del virus sigue sin estar clara.
En diciembre de 2019, se informó de una nueva enfermedad similar a la neumonía en Wuhan, provincia de Hubei, China. En marzo de 2020, la Organización Mundial de la Salud (OMS) declaró que el brote mundial de COVID-19 era una pandemia.
Ahora, más de un año después de su primera aparición, el virus ha llegado a 192 países y territorios. Hasta el momento, se han confirmado más de 109,14 millones de casos y más de 2,40 millones han perdido la vida.
Dado que el origen animal y la evolución del SARS-CoV-2 siguen sin resolverse, los científicos del Instituto Francis Crick en Londres, Reino Unido, exploraron la estructura de unión y las propiedades de la glicoproteína coronaria del pangolín para ver si podría arrojar luz sobre la evolución del SARS. -CoV-2.
La fuente del SARS-CoV-2
Desde que se informó por primera vez sobre el virus, muchos científicos han estado explorando sus orígenes zoonóticos y su evolución. Al igual que los brotes anteriores de Betacoronavirus (del mismo subgénero que el SARS-CoV-2), como el síndrome respiratorio agudo severo (SARS) en 2002 en China y el síndrome respiratorio de Oriente Medio (MERS) en 2012 en Arabia Saudita, los murciélagos en herradura fueron El caballo es la fuente probable. A partir de ahí, se cree que el virus saltó de un huésped intermedio hasta ahora desconocido.
Los coronavirus de murciélagos y pangolines se han implicado en el origen y evolución de la pandemia COVID-19. Como se mencionó anteriormente, el SARS-CoV-2 pertenece a un subgénero de virus sórbicos, que prospera tanto en murciélagos de herradura como en pangolines.
A través de un estudio anterior, el equipo de investigación actual ha demostrado que es poco probable que el coronavirus de murciélago RaTG13, el pariente conocido más cercano del SARS-CoV-2, infecte células humanas, ya que la proteína de pico tiene una baja afinidad con la enzima convertidora de angiotensina humana 2 (ACE2 ) receptores.
Como resultado, se ha planteado la hipótesis de que el SARS-CoV-2 puede llegar a los humanos a través de un huésped intermedio. Varios estudios han informado de la presencia de sarcovirus muy similares al SARS-CoV-2 en pangolines malasios enfermos. Como tales, se consideró que los pangolines desempeñaron un papel en el surgimiento de la epidemia.
Propiedades de unión de ACE2
En el estudio publicado en la revista Comunicaciones de la naturalezaY el El equipo analizó las propiedades de unión de la enzima convertidora de angiotensina 2 y la estructura de la proteína S del Coronavirus Pangolin (CoV) estrechamente relacionado con el SARS-CoV-2.
Para llegar a los resultados del estudio, los investigadores expresaron y purificaron dos dominios elevados exógenos de Pangolin-CoV, que podrían caracterizar la elevación del virus del pangolín y compararlo con el SARS-CoV-2. Para ello, el equipo se basó en una secuencia de virus aislados de un oso hormiguero escamoso que fue incautado en la provincia china de Guangdong en 2019.
Además, el equipo sintetizó bandas externas de proteínas ACE2 de humanos, murciélagos y pangolines para ensayos comparativos.
El equipo descubrió que las proteínas del pangolín mostraban una fuerte unión a la ACE2 humana, una asociación diez veces más débil con la pangolina ACE2 y un vínculo débil a la ACE2. Se observó un patrón de asociación similar para el SARS-CoV-2, que tenía una fuerte asociación con la ECA2 humana.
El equipo agregó que la estructura de Pangolin-CoV S se asemeja a la forma cerrada de SARS-CoV-2 S y RatG13 S.
Todas las observaciones apuntan a las muchas diferencias basadas en secuencias que hacen que el coronavirus de pangolín adopte una formación completamente cerrada. La conformación cerrada de Pangolin-CoV S es notablemente similar, fuera del dominio de unión al receptor (RBD), con RaTG13 S, lo que indica que la estructura de este último no se vio afectada físicamente por la unión sináptica.
Los científicos creen que el papel de la morfología cerrada era proteger el aparato de fusión, mientras que se requiere un estado de confirmación abierto para facilitar la unión del receptor.
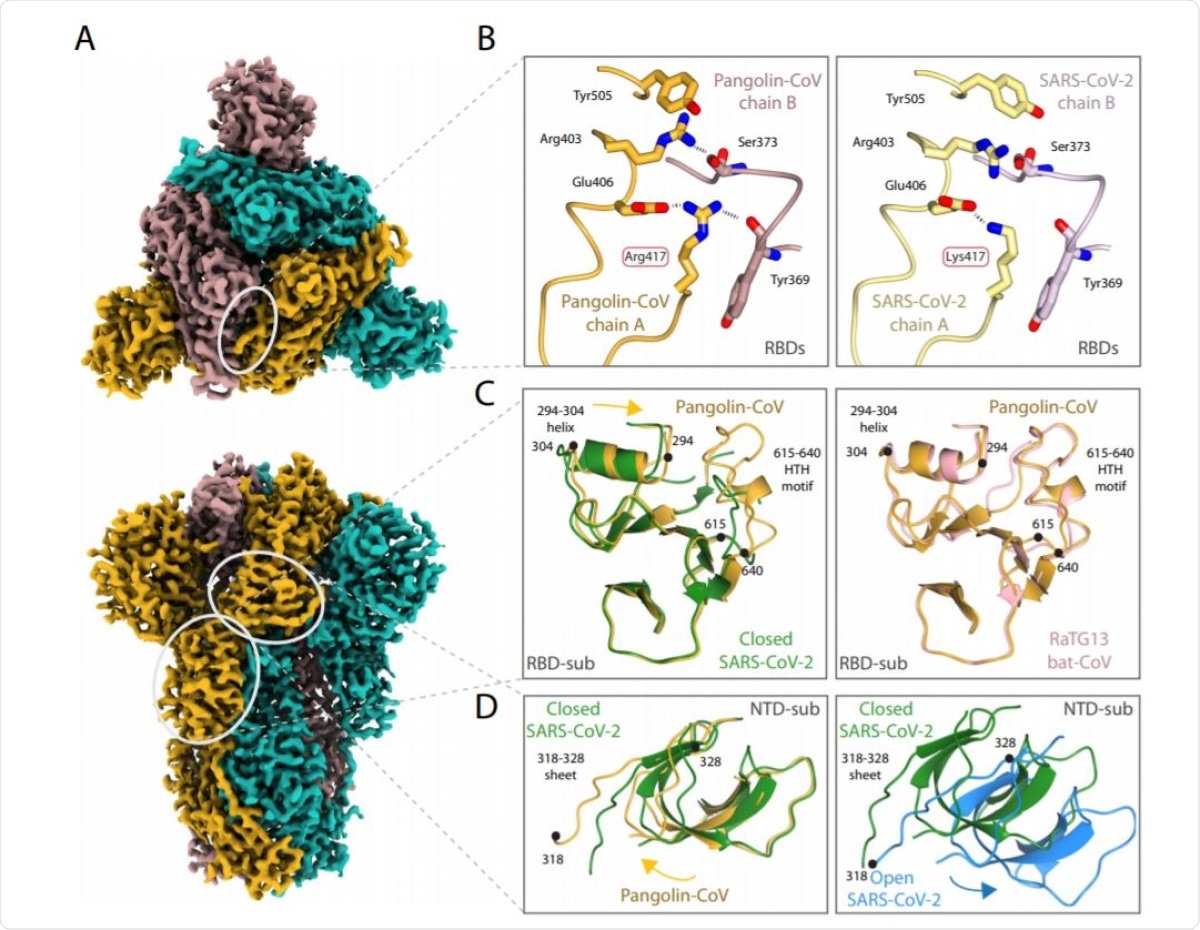
La estructura del pico de proteína pangolín-CoV. Representación de densidad EM de un mapa Pangolin-CoV S2.9 visto desde la parte inferior del eje de tres pliegues (panel superior) y en la vista ortogonal (panel inferior). Las subunidades están coloreadas en azul marino, dorado y marrón rosado. Las elipses blancas marcan las regiones que se muestran en la representación molecular de la derecha. B Comparación de la interfaz pangolin-CoV RBD / RBD (izquierda) y SARS-CoV-2S (PDB: 6ZGE, derecha) que destaca el reemplazo de Arg417Lys. C Comparación de subdominios asociados a RBD de pangolin-CoV (oro) y forma cerrada de SARSCoV-2 (verde) en el panel izquierdo, que muestra las diferentes posiciones de la hélice 294-304 y la presencia de 615-640 hélice girada en la estructura del pangolín, y en el panel derecho, la misma estructura Pangolin-CoV S (dorado) superpuso la región correspondiente de RaTG13 (PDB: 6ZGF) (rosa). Comparación (izquierda) del subdominio asociado a NTD de Pangolin-CoV (oro) con el dominio cerrado de SARS-CoV-2 (verde) que muestra las diferentes direcciones de campo entre ellos; (Derecha) coincidencias de subdominio cerrado (verde) y abierto (azul) para NTD para SARS-CoV-2 que demuestran que el cambio en la dirección del subdominio asociado con NTD al abrir el pico es en la dirección opuesta al cambio visible entre las conciliaciones Pangolin-CoV y SARS-CoV-2 adjuntas se muestran en el panel izquierdo.
El estudio también mostró que la presencia de RBD mejorados por los receptores ACE2 abre el recorrido del SARS-CoV-2 y los predispone a una fusión de membrana exitosa. La morfología abierta de la elevación del SARS-CoV-2 puede ayudar a establecer un evento cinemático al principio del proceso de unión.
Además, el componente proteico S no RBD SARS-CoV-2 S es comparable a la proteína del virus del murciélago RaTG13, con una identidad del 96% con S1. Mientras tanto, su identidad de secuencia es solo del 76 por ciento en RBD.
Por el contrario, la secuencia y el RBD de SARS-CoV-2 es similar a la de Pangolin-CoV, principalmente en el sitio de unión de ACE2. La estrecha similitud de RBD entre Pangolin-CoV y SARS-CoV-2 está relacionada con las propiedades de unión casi idénticas de S.
Los investigadores sugieren que el rango efectivo del animal para esta clase de virus MERS distintos de los murciélagos podría incluir otras especies como los pangolines. Estos animales tienen receptores ACE2 similares a los ACE2 humanos. Puede haber patógenos no específicos, como virus que albergan RBD de la misma secuencia y características de unión de SARS-CoV-2 y Pangolin-CoV.
Comprender estas similitudes y diferencias también podría ayudar a los científicos a explorar otros animales hospedadores potenciales, lo que a su vez podría orientar las medidas preventivas para brotes de enfermedades zoonóticas similares en el futuro.

«Propenso a ataques de apatía. Explorador de aspirantes. Analista ávido. Fanático de Internet. Comunicador»







More Stories
Un fenómeno parecido a un arco iris puede brillar en el infernal exoplaneta WASP-76b
El caos cósmico y las pistas en rápidas ráfagas de radio
SpaceX lanzará satélites Starlink en la misión número 40 de la compañía en 2024