Los dominios de proteínas de baja complejidad (LCD) se acumulan para formar gotitas de fluido dinámico dentro de la célula; Desafortunadamente, algunas mutaciones causantes de enfermedades en estas regiones fomentan el ensamblaje fuera de este estado fisiológico temporal. ¿Qué enciende el interruptor? Algo parece efímero como un pequeño enlace de hidrógeno, según investigadores dirigidos por Stephen McKnight y Glenn Liszczak, MD, University of Texas Southwestern Medical Center, Dallas. En la edición del 1 de julio de Science, informan que las mutaciones en la prolina, que liberan el enlace principal entre el nitrógeno y el hidrógeno, estabilizan indebidamente las reservas de péptidos LCD. Limitando experimentalmente esta solubilidad de nitrógeno medida en un péptido. Esto fue cierto para mutaciones puntuales en tau, neurofilamentos ligeros (NfL), proteínas de unión a ARN TDP-43 y hnRNPA2. Todos ellos están relacionados con enfermedades neurodegenerativas.
- Las mutaciones de prolina permiten el enlace nitrógeno-hidrógeno en el esqueleto de la proteína.
- Esto fortalece las placas cruzadas entre los péptidos, formando fibrillas.
- La metilación del nitrógeno de la cadena principal normaliza la estructura de la proteína.
«este trabajo [provides] David Eisenberg, Universidad de California, Los Ángeles escribe (comentario completo a continuación):
Escrito por Dorothy Dormann, Johannes Gutenberg, Universidad de Mainz, Alemania (comentario completo a continuación). Ben y Lusine de la Universidad de Boston estuvieron de acuerdo y señalaron que «este es uno de los factores acumulativos que lleva a la agregación de TDP-43».
Las LCD de TDP-43, tau y hnRNA2 se ensamblan formando láminas reticuladas, lo que permite que las proteínas se deslicen parcialmente fuera del citosol como gotas líquidas, algo similar al aceite suspendido en el agua (Noticias de marzo de 2019; Noticias de agosto de 2017; Noticias de febrero de 2018). ). ¿Qué impulsa la separación de fases líquido-líquido?
El primer autor, Xiaoming Zhou, sospechó que existen enlaces de hidrógeno en las columnas vertebrales porque son esenciales para la formación de placas. Generó 23 variantes de la región LCD de TDP-43, un péptido compuesto por 150 aminoácidos, cada uno de los cuales contiene un solo aminoácido alterado en la porción conservada de la proteína. Los aminoácidos sintéticos contenían nitrógeno metilado en el esqueleto para evitar los enlaces de hidrógeno intermoleculares. Luego, Zhou utilizó la microscopía para analizar la capacidad de cada péptido para someterse a una separación de fases en una solución isotónica neutra.
Nueve variables no lograron fusionarse en gotitas líquidas. Todos los residuos mutantes cayeron dentro de la región que forma el núcleo de la hoja (noticias de diciembre de 2021). «Esta eliminación de un solo enlace de hidrógeno básico que puede alterar toda la estructura muestra cuán débil y, por lo tanto, dinámica y reversible, la autocorrelación», Gregory Petscoe, Escuela de Medicina de Harvard, Boston, y Scott Small, Universidad de Columbia, Nueva York, en un editorial. en el mismo número de la revista Science. Los investigadores creen que los enlaces de hidrógeno del esqueleto peptídico son esenciales para el autoensamblaje de las hojas y la separación de fases.
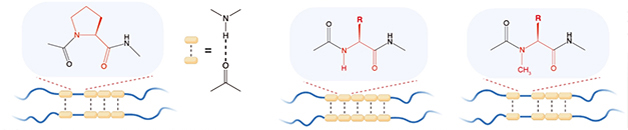
Las cadenas laterales de aminoácidos también pueden influir en la estructura del péptido. Zhou reemplazó sistemáticamente cada aminoácido en la región LCD TDP-43 conservada con glicina. Curiosamente, el cambio más profundo se produjo en el mutante prolina-320, que rápidamente se convirtió en marañas en lugar de fusionarse en gotas líquidas. Esta mutación liberó la cadena principal de residuos del enlace nitrógeno-hidrógeno. Cuando los científicos cubrieron este nitrógeno al incorporar N-metil glicina en el péptido LCD, las gotas se formaron nuevamente. Los autores concluyeron que la liberación de este esqueleto de nitrógeno estabilizó los agregados mutables para que precipiten (ver imagen a continuación).
¿Velcro de hidrógeno? El enlace de hidrógeno básico (líneas de puntos) se conecta a algunas bandas de baja complejidad (líneas azules). Estos dominios siguen siendo degradables debido a la prolina reticulada (izquierda), que no puede formar enlaces H. Reemplazar cualquier otro residuo permite que los enlaces H de la cadena principal (centro) estabilicen las placas transversales. Esto se invierte mediante la metilación del nitrógeno básico (derecha) para restaurar el enlace H. [Courtesy of Zhou et al., Science, 2022.]
¿Podrían las mutaciones en la secuencia de ADN que codifica la prolina explicar por qué las variantes en otras proteínas propensas a la agregación aumentan el riesgo de enfermedad neurodegenerativa? De hecho, se sabe que la conversión de prolina a otro aminoácido dentro de la LCD de tau causa tauopatía, y los intercambios de prolina en NfL causan neuropatía periférica hereditaria en la enfermedad de Charcot-Marie-Tooth, y en hnRNPA2, esclerosis lateral amiotrófica y el trastorno óseo enfermedad de Paget. (Jordanova). ) et al., 2003; Shen et al., 2008; Chi et al., 2017).
Específicamente, los péptidos de dominio medio tau que albergan P301S, P301T o P301L tienen una fuerte tendencia a agregarse y secuestrar el tinte de tioflavina-T, que cambia su fluorescencia después de adherirse a las proteínas agregadas. De manera similar, seis de los mutantes de prolina NfL se polimerizan fácilmente para formar enlaces cruzados amorfos en lugar de cadenas de tipo salvaje. La porción LCD de hnRNPA2 que contenía P298L se ensambló y se mezcló en gotas de líquido deformadas, según investigaciones anteriores (Noticias de febrero de 2018). Para cada una de estas proteínas mutantes, la incorporación de aminoácidos N-metilados para evitar enlaces de hidrógeno adicionales revirtió su estabilidad y solubilidad al tipo salvaje (ver imagen a continuación).
fuera del escenario Las mutaciones patógenas de prolina hacen que NfL se entrecruce aleatoriamente (arriba a la izquierda), que tau se ensamble cuando no debería (centro a la izquierda) y que hnRNPA2 se integre en gotitas de líquido aparentemente distorsionadas (abajo a la izquierda). La metilación de la cadena de nitrógeno principal del aminoácido mutado restauró las tres proteínas a sus coincidencias de tipo salvaje (paneles de la derecha). [Courtesy of Zhou et al., Science, 2022.]
¿Una advertencia de estas experiencias? Solo incluyeron la porción LCD de cualquier proteína dada, no la secuencia completa. «Lo que es tan claro acerca de un péptido pequeño como este es aún más misterioso cuando estudias la proteína completa», dijo Woolusine a Alzforum. Aún no está claro cuán relevantes son estos hallazgos patológicos.
Dan Li, de la Universidad Jiao Tong de Shanghai, China, se preguntó sobre el descubrimiento de placas cruzadas mutables en células o tejidos. Aunque no proporciona una visión intracelular directa, el escaneo de la mutagénesis profunda permite el estudio sistemático de miles de variantes en la estructura de la proteína y el ensamblaje intracelular (Starita et al., 2017). «Es posible revelar los patrones estructurales y el estado de ensamblaje in vivo de las proteínas que contienen LCD de longitud completa y determinar su efecto sobre la aptitud celular», según el acuerdo de Benedetta Bolognese, Instituto de Bioingeniería de Cataluña, Barcelona, España. (Comentarios completos más abajo).
Mediante el análisis de mutaciones profundas, Bolognesi descubrió que, de las 52 000 mutaciones dentro de la LCD TDP-43, la región conservada era un punto de acceso para la creación de mutaciones tóxicas que formaban agregados sólidos en lugar de gotitas líquidas (Bolognesi et al., 2019). Curiosamente, el patrón de interacciones entre los mutantes de LCD sugirió dos estructuras en esta región: la hoja β en los residuos 311 a 315 y la hélice α en 324 a 331.
Los investigadores debaten qué estructura secundaria corresponde a la región conservada de TDP-43. Algunos han informado que las hélices alfa TDP-43, no las láminas, impulsan la separación de fases líquido-líquido (Noticias de septiembre de 2016). Esto plantea la cuestión de si las placas cruzadas realmente controlan la separación de fases de la pantalla LCD, ya que el estudio de Zhou no incluyó experimentos estructurales. «Una posibilidad alternativa podría ser que los grupos metilo introducidos interfieran con la conformación helicoidal y, por lo tanto, interfieran con la separación de fases de TDP-43», escribió Dorman. Los laboratorios que participan directamente en esta discusión se negaron a comentar. Chelsea Weidmann Burke
citas de noticias
-
Más evidencia de las caídas características de TDP-43
-
Más gotas de Tao
-
¿Está el amiloide inverso detrás de la separación de la fase líquida del líquido?
-
La doble hélice TDP-43 se distingue de otros amiloides
-
¿Cómo evitan las neuronas recolectar gotitas de proteína líquida?
-
La cola de caracol domina el bote TDP-43.
Citas de mutación
-
MAPT P301S
-
MAPT P301T
-
MAPT P301L
cotizaciones de papel
-
Jordanova A, De Jonghe P, Boerkoel CF, Takashima H, De Vriendt E, Ceuterick C, Martin JJ, Butler IJ, Mancias P, Papasozomenos SC, Terespolsky D, Potocki L, Brown CW, Shy M, Rita DA, Tournev I, Kreminsky I, Lubsky Jr., Timmerman F..
Las mutaciones en el gen de la cadena ligera del filamento neural (NEFL) provocan la aparición temprana de la enfermedad de Charcot-Marie-Tooth aguda..
cerebro. 2003 marzo; 126 (parte 3): 590-7.
PubMed. -
Shin JS, Chung KW, Cho SY, Yun J, Hwang SJ, Kang SH, Cho EM, Kim SM, Choi BO.
Mutación NEFL Pro22Arg en la enfermedad de Charcot-Marie-Tooth tipo 1.
j hum jenny. 2008; 53 (10): 936–940. Epub 2008 29 de agosto
PubMed. -
Qi X, Pang Q, Wang J, Zhao Z, Wang O, Xu L, Mao J, Jiang Y, Li M, Xing X, Yu W, Asan, Xia W.
Enfermedad ósea de Paget familiar temprana asociada con una nueva mutación hnRNPA2B1.
Tejido Calcif Int. 2017 agosto; 101 (2): 159-169. Epub 2017 7 de abril
PubMed. -
Starita LM, Ahituv N, Dunham MJ, Kitzman JO, Roth FP, Seelig G, Shendure J, Fowler DM.
Interpretación de variables: exámenes funcionales al rescate.
Soy J Hum Genet. 7 de septiembre de 2017; 101 (3): 315-325.
PubMed. -
Bolognesi B, Faure AJ, Seuma M, Schmiedel JM, Tartaglia GG, Lehner B.
Paisaje mutacional de un dominio similar a un prión.
común natural. 13 de septiembre de 2019; 10 (1): 4162.
PubMed.

«Propenso a ataques de apatía. Explorador de aspirantes. Analista ávido. Fanático de Internet. Comunicador»







More Stories
La línea de luz IRIS en BESSY II obtiene una nueva estación final para espectroscopía a nanoescala
Formación de formadores expertos en Libia – IARC
Por primera vez, los científicos capturan en vídeo la danza de las proteínas y las grasas: ScienceAlert